Study on the effect of zinc or aluminium salt treatments on the surface properties of TiO2
-
摘要: 硫酸法钛白生产工艺中,盐处理剂的选择对金红石二氧化钛晶体的表面性质有着重大影响,有必要对不同盐处理剂造成的钛白粉表面性质差异进行深入研究,揭示不同盐处理剂所引发的表面性质差异。采用SEM、XPS、BET等仪器分别研究了锌系盐处理和铝系盐处理的金红石样品的表面形貌、晶体表面缺陷、表面羟基的差异。结果表明:铝系盐处理的金红石样品呈现长条形,在沉降过程中受更大的沉降阻力,且铝系盐处理金红石样品表面存在更多的晶体缺陷、表面羟基,同时对水分子的解离作用更明显,在水分散体系有更高的表面电位,更容易形成更稳定的分散体系。Abstract: In the production process of titanium dioxide by sulfuric acid method, the selection of salt treatment agents has a significant impact on the surface properties of rutile titanium dioxide crystals. Thus it is necessary to carry out an in-depth study to reveal the differences in the surface properties of titanium dioxide caused by different salt treating agents. In this study, the differences in surface morphology, crystal surface defects, and surface hydroxyl groups of rutile samples treated with zinc-based salt and aluminium-based salt were investigated using SEM, XPS, and BET instruments, respectively. The results show that the aluminium salt-treated rutile samples present elongated shape and suffer from greater sedimentation resistance during the sedimentation process. Meanwhile, the aluminium salt-treated rutile samples have more crystal defects and surface hydroxyls on the surface than the zinc salt-treated samples, and also have more pronounced dissociative effects on water molecules, higher surface potential in the water-dispersed system, and are more capable of forming more stable dispersed systems.
-
0. 引言
二氧化钛具有优异的白度、着色力、遮盖力、耐候性、化学稳定性和无毒等特点,作为性能最为优越的白色颜料和世界第三大无机化学品,被广泛运用在诸多工业生产领域。近年来,随着全球对钛白粉的需求逐年增加,我国钛白粉的产能和年产量也逐年提高,2023年我国的钛白粉总产量为416万t,其中金红石型产量为360万t,占比为86.53%。金红石型钛白粉的工业生产工艺主要有硫酸法和氯化法两种路线。我国的金红石型钛白粉生产主要以硫酸法工艺为主,通过酸解、水解等工艺将钛铁矿等原料制得偏钛酸,而后对偏钛酸进行盐处理和高温煅烧, 使其转化成金红石型二氧化钛,在该过程中,盐处理剂的选择将对金红石二氧化钛晶体的煅烧温度、砂磨分散性以及最终的产品性能等造成影响。
目前国内所采用的盐处理剂主要分为锌盐或铝盐搭配形成的锌系盐处理剂和铝系盐处理剂两大类,研究也大多集中在不同的盐处理剂的掺杂对煅烧过程中晶型转变、钛白粉颜料性能的影响以及相应煅烧工艺条件的优化等方面。LIU等[1]研究了煅烧过程中锌系与铝系盐处理剂对金红石晶体的生长过程与转变温度的影响。WU等[2]对比分析了锌盐和铝盐处理对钛白初品性质的影响。LU等[3]研究了不同添加比例下的铝锌复合盐处理剂对二氧化钛的晶体转变过程、粒径以及颜料性能的影响,发现Al2O3加量较高时会抑制金红石转化,而ZnO则会促进金红石转化。CAO等[4]研究了Al3+掺杂对二氧化钛晶粒生长的影响机制,发现当Al3+迁移至金红石晶体的(110)和(100)晶面上时,会使金红石晶粒呈细长条形。MA和RONG等[5-6]分别研究了在金红石型二氧化钛煅烧过程中的K+和P5+对二氧化钛晶粒大小和晶型转化的影响,发现煅烧后钾元素和磷元素分别以K2SO4和P2O5稳定存在,不溶于TiO2晶粒,仅存在于TiO2颗粒表面。
目前的研究多是基于不同盐处理剂的加入所造成的金红石二氧化钛晶体转化差异和产品性能差异而开展,关于锌和铝离子掺杂所造成的晶体表面性质的差异却少见报道。由于锌系盐处理剂和铝系盐处理剂中的钾元素和磷元素不能掺入晶格中,对二氧化钛晶体的影响较小,而Zn2+和Al3+的离子半径和电负性与Ti4+较为接近,易于以取代掺杂的模式掺入TiO2晶格,引起TiO2晶体发生不同程度的晶格畸变,在晶体表面产生如氧空位、原子氢等缺陷,进而对TiO2的表面性质,如表面自由能、表面电荷及润湿性等有显著影响[7−11]。盐处理剂掺杂所引起的二氧化钛颗粒表面性质差异对其生产过程中的打浆、包膜与分散性能影响极大,因此有必要对不同盐处理剂造成的钛白粉表面性质差异进行深入研究,揭示不同盐处理剂所引发的表面性质差异。
为了探究Zn2+或Al3+对TiO2进行掺杂所引起的表面性质差异,笔者选择攀枝花某硫酸法钛白生产厂家的锌系和铝系两种盐处理煅烧出的金红石型钛白辊压初品作为试验原料,通过SEM、XPS、BET等手段,系统表征并对比了二者表面形貌、晶体表面缺陷、表面羟基等差异,揭示不同盐处理剂掺杂造成的高浓度砂磨分散性差异的根本原因,为在实际生产中选择合适的分散剂及砂磨方案,提高二氧化钛初品打浆浓度和砂磨效率,获得分散性能更佳的钛白产品提供指导生产。
1. 试验部分
1.1 试验原料
选择攀枝花某硫酸法钛白生产厂家的锌系和铝系两种盐处理煅烧出的金红石型钛白辊压初品作为试验原料,分别为:锌系盐(K2O+P2O5+ZnO)处理1#、2#样;铝系盐(K2O+P2O5+Al2O3)处理3#、4#样。将上述样品称取一定质量,采用三头研磨机研磨1 h,研磨后对样品进行测试分析。
1.2 试验仪器
试验所用主要仪器如表1所示。
表 1 主要试验仪器Table 1. Primary test instruments仪器 型号 厂家 三头研磨机 RK/XPM-Ø120×3 武汉洛克粉磨设备
制造有限公司扫描电子显微镜 Gemini SEM 300 德国ZEISS X射线光电子能谱仪 K-Alpha 美国Thermo Scientific 热重分析仪 TG 209 F1 德国Netzsch 全自动比表面及
孔隙度分析仪ASAP 2460 美国Micromeritics Zeta电位分析仪 Zetasizer Nano ZS90 Malvern 1.3 表征方法
1.3.1 金红石TiO2表观形貌表征
使用德国ZEISS GeminiSEM 300扫描电子显微镜对Zn和Al掺杂金红石TiO2纳米颗粒进行表观形貌表征。
1.3.2 金红石TiO2表面元素化学态表征
使用美国Thermo Scientific K-Alpha X射线光电子能谱仪(XPS)对样品进行扫描测试,对二氧化钛表面Ti、O元素的化学态进行分析,可以定性和定量的对比在煅烧过程中Zn2+或Al3+掺杂所导致的金红石TiO2晶体表面缺陷的差异。
1.3.3 金红石TiO2表面羟基数量测定
根据二氧化钛表面羟基的形成机理不同及其热稳定性差异的特性,采用热重分析仪(TGA)结合比表面积测试仪(BET)对不同样品的表面羟基数量进行分析[12−13]。首先将样品从室温升高到120 ℃,保持10 min以去除物理吸附的水;随后将温度从120 ℃升高到500 ℃保持5 min,此时失去的水为末端羟基缩合产生的水。根据TGA在120~500 ℃区间的热失重(a)和BET测得的比表面积(S)通过式(1)可计算出TiO2粉末的相对表面OH密度。
$$ N_{\mathrm{OH}}=\frac{a\times2\times6.02\times10^{23}}{S\times10^{18}\times18} $$ (1) 1.3.4 金红石TiO2表面电荷表征
在实际生产的打浆和砂磨过程中,二氧化钛浆料的浓度通常很高,浆料颗粒含量为10%~50%,而极高的颗粒含量的浆料原液会严重影响Zeta电位的测量,无法得到真实的电位结果,而将高浓度溶液稀释的方法则会改变溶液的化学成分,同样不能准确客观反映高浓度体系的真实电位。为准确反应高浓度溶液的真实点位,根据文献[14]中报道的方法,首先称取一定量的球磨后的金红石二氧化钛样品与去离子水配置成浓度为10%的待测分散液,再将待测二氧化钛分散液样品以
5000 r/min的转速进行高速离心,离心时间30 min,获得仅改变颗粒浓度,而液体介质环境、离子浓度和pH值不变的上清液,使用马尔文Zetasizer Zeta电位仪对分离出的样品上清液进行Zeta电位测定,测试三次取其平均值。2. 结果与讨论
2.1 表观形貌差异
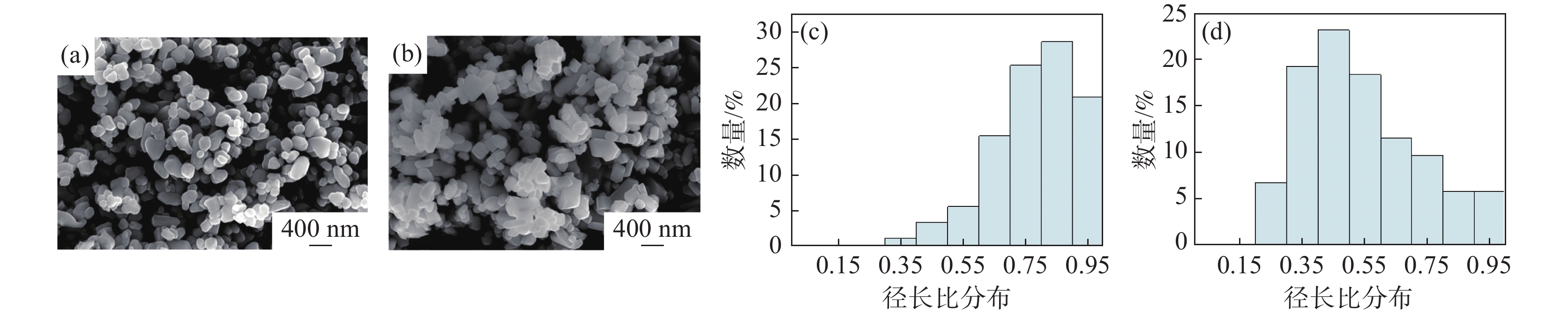
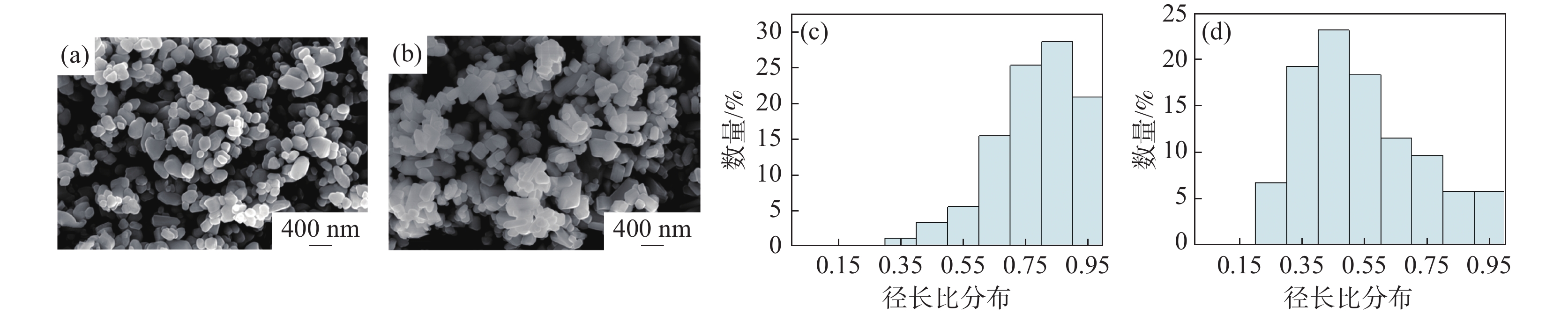
为研究Zn2+和Al3+掺杂对TiO2 晶体造成的表观形貌的差异,采用SEM对球磨后的粉末样品进行表征测试。图1(a)~(b)分别为取自不同生产线上的锌系金红石辊压磨样品和铝系金红石辊压磨样品经三头球磨机球磨30 min后的SEM图片。由图可知,锌系金红石粒子呈现为边缘圆润的椭球形,而铝系金红石粒子为长条形,二者形貌具有明显差异。为进一步定量分析二者形貌的差异,选择400 nm标尺的SEM照片,采用NanoMeasurer 1.2软件人工随机统计100个粒子,对颗粒的径长比分布进行统计分析,结果见图1(c)~(d)。颗粒形貌及颗粒径长比分析结果表明:锌系金红石样品的径长比集中在0.7~1.0,最大分布为0.85,样品形貌接近于椭球形;铝系金红石样品的径长比集中在0.3~0.7,最大分布为0.45,铝系样品更接近长条形。这是因为Al3+迁移至TiO2晶体的(110)和(100)晶面上时,Al3+会抑制晶体沿(110)和(100)晶面生长,因此晶粒呈细长条形[4, 15]。而Zn2+则会抑制二氧化钛晶粒尺寸生长,得到粒径更小的二氧化钛晶粒[16]。根据Stokes定律,颗粒沉降速率受颗粒形状影响,颗粒的球形度越差,受到的沉降阻力越大,沉降速率越慢。而锌系样品在二维层次上集中在0.7~1.0的径长比表明其在三维形态具有较好的球形度,而铝系金红石样品集中在0.3~0.7的径长比表明其球形度远差于锌系样品,从表观形貌角度,受颗粒形状影响,铝系样品在沉降过程中有更慢的沉降速率,有利于达到更稳定的分散效果,因此铝系样品相对锌系样品具有更好的分散稳定性。
 图 1 (a)锌系金红石TiO2样品SEM形貌;(b)铝系金红石TiO2样品SEM形貌;(c)锌系样品径长比分布;(d)铝系样品径长比分布。Figure 1. SEM image of zinc-based rutile TiO2 sample (a), SEM image of aluminium-based rutile TiO2 sample (b), diameter-to-length ratio distribution of zinc-based sample (c) and diameter-to-length ratio distribution of aluminium-based sample(d)
图 1 (a)锌系金红石TiO2样品SEM形貌;(b)铝系金红石TiO2样品SEM形貌;(c)锌系样品径长比分布;(d)铝系样品径长比分布。Figure 1. SEM image of zinc-based rutile TiO2 sample (a), SEM image of aluminium-based rutile TiO2 sample (b), diameter-to-length ratio distribution of zinc-based sample (c) and diameter-to-length ratio distribution of aluminium-based sample(d)2.2 表面元素价态差异
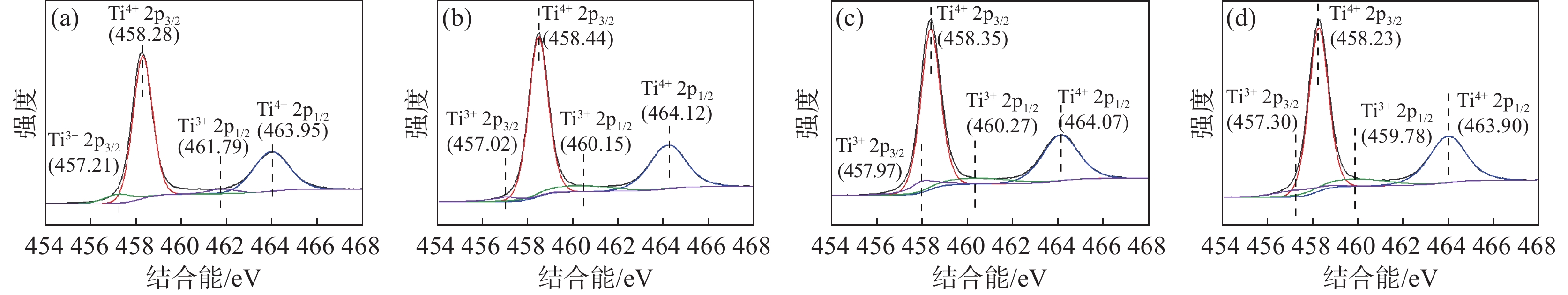
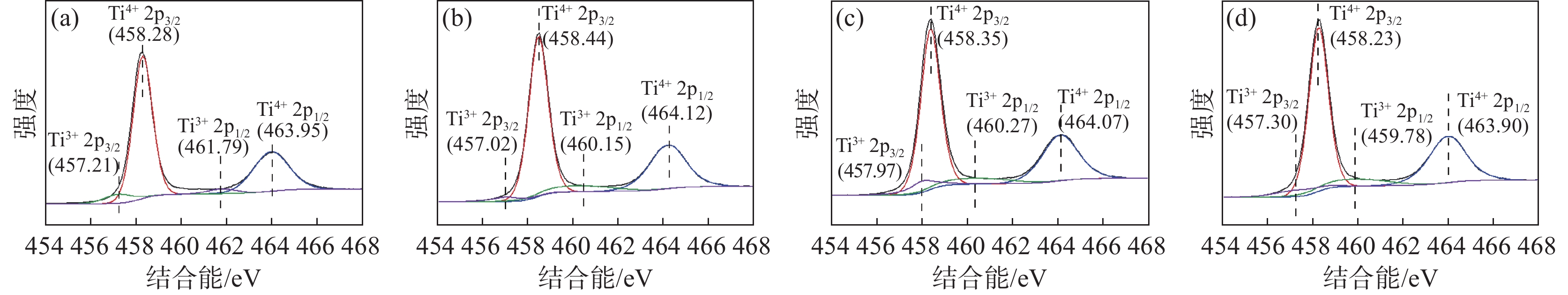
图2为锌/铝掺杂的金红石TiO2纳米颗粒的Ti 2p XPS分析结果。结合能在458 eV和464 eV的峰位分别为Ti4+ 2p3/2轨道和Ti4+ 2p1/2轨道,结合能在457 eV和461 eV的峰位分别为Ti3+ 2p3/2轨道和Ti3+ 2p1/2轨道,Ti化学种类定量分析结果见表2。铝系样品晶体表面的Ti3+含量整体高于锌系样品晶体表面的Ti3+含量,表明铝系样品的晶体表面具有更多的缺陷。
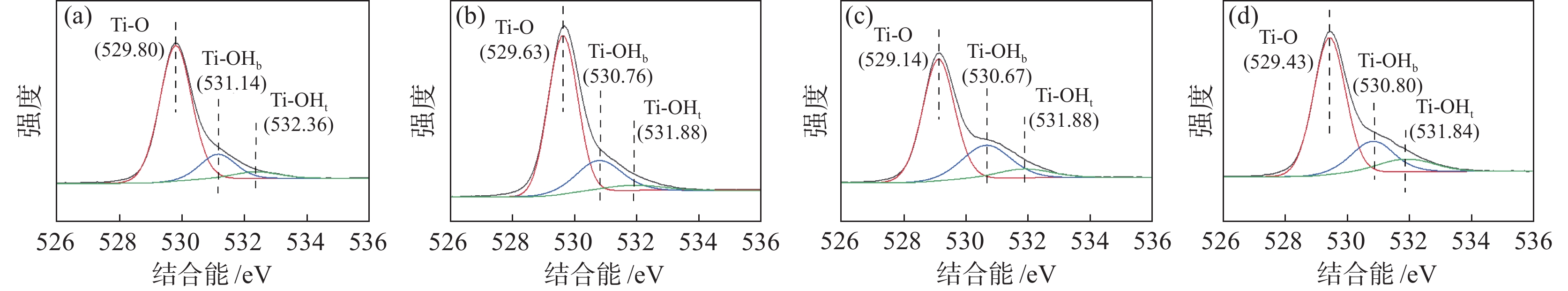
表 2 TiO2 NPs上的Ti化学种类定量分析Table 2. Quantitative analysis of Ti chemical species on TiO2 NPs% TiO2 NPs 锌系-1# 锌系-2# 铝系-3# 铝系-4# Ti4+ 91.63 89.63 86.75 86.68 Ti3+ 8.57 10.37 13.25 13.32 图3为锌/铝掺杂的金红石TiO2纳米颗粒的O 1s XPS分析结果。结合能在529 eV的峰位为Ti-O 1s轨道,结合能在530.5~531.7 eV的峰位为O空位吸附氧,对应为金红石表面的桥接羟基(OHb),结合能在531.8~532.8 eV的峰位对应为金红石表面末端羟基(OHt)中的吸附氧。
TiO2 NPs上的O化学种类定量分析结果见表3。铝系样品晶体表面的末端羟基(OHt)和桥接羟基(OHb)的含量整体高于锌系样品晶体表面的末端羟基(OHt)和桥接羟基(OHb)含量,这是由于铝系样品表面有更多的氧空位存在。
表 3 TiO2 NPs上的O化学种类定量分析Table 3. Quantitative analysis of O chemical species on TiO2 NPs% 类别 锌系-1# 锌系-2# 铝系-3# 铝系-4# Ti-O 78.97 70.84 65.33 68.11 Ti-OHb 14.76 22.51 26.74 20.85 Ti-OHt 6.26 6.65 7.92 11.04 在完美的金红石型TiO2(110)晶体表面,主要存在五配位钛(Ti5c)和六配位钛(Ti6c)两种钛离子,而二氧化钛在高温煅烧过程中,会造成其晶格中的氧脱离,导致氧缺失,在其表面形成桥接氧空位(Ov)[17−20]。伴随着桥接氧空位的产生,金红石表面的过量电子被两个桥接羟基间的Ti6c和附近Ti5c的Ti4+离子捕获,这两个钛离子被还原为Ti3+,且水分子在此解离并形成一对羟基后不会消失[7, 21−23]。相对于锌系金红石,铝系金红石在煅烧过程中需要更高的煅烧温度完成金红石晶型的转化,且Al3+离子半径(50 pm)和Ti4+离子半径(68 pm)相差较大,在煅烧过程中掺杂入二氧化钛晶体表面形成了更多的晶体畸变[17−23],因此铝系金红石晶体表面具有更多的氧空位的存在,使其表面末端羟基的含量和桥接羟基的含量明显高于锌系样品。
2.3 表面羟基数量差异
通过XPS对二氧化钛表面氧元素的化合价分析可以在一定程度上表征二氧化钛表面羟基占比的差异,为定量区分锌铝掺杂所造成的二氧化钛表面的羟基差异,我们结合BET和TG对金红石二氧化钛的表面羟基数量进行了表征,结果如表4所示。
表 4 Zn/Al掺杂金红石TiO2相对表面羟基密度测定结果Table 4. Relative surface hydroxyl density measurements of Zn/Al doped rutile TiO2样品 热失重/% BET测试结果/(m²·g−1) NOH /nm2 锌系-1# 0.152 6.1235 16.6 锌系-2# 0.237 6.0489 26.2 铝系-3# 0.268 5.5840 32.1 铝系-4# 0.296 5.7895 34.25 表4为不同Zn/Al掺杂金红石TiO2样品的表面羟基密度测定结果。由表中数据可知,铝系金红石初品的相对表面羟基密度明显高于锌系样品的相对表面羟基密度。该结果与Zn/Al掺杂金红石TiO2晶体表面的Ti3+含量和晶体表面的末端羟基的含量测试结果具有一致性,表明了铝系样品在煅烧过程中由于铝离子的掺杂出现了更多的表面缺陷位点,这些表面缺陷位点作为活性位点促进了水分子在其表面的解离,因此形成了更多的表面羟基。
2.4 表面电性差异
Zn/Al掺杂金红石TiO2水分散液Zeta电位测定结果如表5所示,从表中可以看出在去离子水中,铝系样品的Zeta电位绝对值要高于锌系样品。这是因为铝系样品表面具有更多的表面氧空位和Ti3+缺陷,能够解离和吸附水分子形成更多的羟基,使其水溶液的电位更高[7, 21−23]。更高的Zeta电位绝对值表明了铝系样品之间有着更高的斥力,在砂磨分散时也有着更好的稳定性和分散性。
表 5 Zn/Al掺杂金红石TiO2水分散液Zeta电位测定结果Table 5. Zeta potential measurement results of Zn/Al doped rutile TiO2 aqueous dispersions样品 Zeta电位/mV 10%锌系-1# −24.7 10%锌系-2# −28.2 10%铝系-3# −39.2 10%铝系-4# −42.3 3. 结论
通过对锌/铝掺杂导致的金红石TiO2粒子在表观形貌、晶体表面缺陷、表面羟基等表面性质的表征与分析,发现锌/铝掺金红石TiO2粒子主要存在如下差异:
1)铝系样品的长条形形貌使其在沉降过程中受到更大的沉降阻力,其沉降速率更慢,有利于达到更稳定的分散效果。
2)相对于Zn2+,Al3+掺杂会使金红石TiO2形成更多的表面氧空位和Ti3+的晶体缺陷。
3)由于Al3+掺杂导致的金红石TiO2晶体表面的更多缺陷,使其存在更多的表面羟基,同时对水分子的解离作用更明显,在水分散体系有更高的表面电位,容易形成更稳定的分散体系。
-
图 1 (a)锌系金红石TiO2样品SEM形貌;(b)铝系金红石TiO2样品SEM形貌;(c)锌系样品径长比分布;(d)铝系样品径长比分布。
Figure 1. SEM image of zinc-based rutile TiO2 sample (a), SEM image of aluminium-based rutile TiO2 sample (b), diameter-to-length ratio distribution of zinc-based sample (c) and diameter-to-length ratio distribution of aluminium-based sample(d)
表 1 主要试验仪器
Table 1. Primary test instruments
仪器 型号 厂家 三头研磨机 RK/XPM-Ø120×3 武汉洛克粉磨设备
制造有限公司扫描电子显微镜 Gemini SEM 300 德国ZEISS X射线光电子能谱仪 K-Alpha 美国Thermo Scientific 热重分析仪 TG 209 F1 德国Netzsch 全自动比表面及
孔隙度分析仪ASAP 2460 美国Micromeritics Zeta电位分析仪 Zetasizer Nano ZS90 Malvern 表 2 TiO2 NPs上的Ti化学种类定量分析
Table 2. Quantitative analysis of Ti chemical species on TiO2 NPs
% TiO2 NPs 锌系-1# 锌系-2# 铝系-3# 铝系-4# Ti4+ 91.63 89.63 86.75 86.68 Ti3+ 8.57 10.37 13.25 13.32 表 3 TiO2 NPs上的O化学种类定量分析
Table 3. Quantitative analysis of O chemical species on TiO2 NPs
% 类别 锌系-1# 锌系-2# 铝系-3# 铝系-4# Ti-O 78.97 70.84 65.33 68.11 Ti-OHb 14.76 22.51 26.74 20.85 Ti-OHt 6.26 6.65 7.92 11.04 表 4 Zn/Al掺杂金红石TiO2相对表面羟基密度测定结果
Table 4. Relative surface hydroxyl density measurements of Zn/Al doped rutile TiO2
样品 热失重/% BET测试结果/(m²·g−1) NOH /nm2 锌系-1# 0.152 6.1235 16.6 锌系-2# 0.237 6.0489 26.2 铝系-3# 0.268 5.5840 32.1 铝系-4# 0.296 5.7895 34.25 表 5 Zn/Al掺杂金红石TiO2水分散液Zeta电位测定结果
Table 5. Zeta potential measurement results of Zn/Al doped rutile TiO2 aqueous dispersions
样品 Zeta电位/mV 10%锌系-1# −24.7 10%锌系-2# −28.2 10%铝系-3# −39.2 10%铝系-4# −42.3 -
[1] LIU C, LU R F, WU J C, et al. Comparative study on the evolution law of zinc salt and aluminum salt treated titanium dioxide particles during calcination[J]. Iron Steel Vanadium Titanium, 2023,44(2):34-39. (刘婵, 路瑞芳, 吴健春, 等. 煅烧过程中锌系与铝系钛白粒子演变规律的对比研究[J]. 钢铁钒钛, 2023,44(2):34-39.LIU C, LU R F, WU J C, et al. Comparative study on the evolution law of zinc salt and aluminum salt treated titanium dioxide particles during calcination[J]. Iron Steel Vanadium Titanium, 2023, 44(2): 34-39. [2] WU J C, LU R F, MA W P. Analysis of difference between zinc salt and aluminum salt treated titanium dioxide[J]. Iron Steel Vanadium Titanium, 2020,41(2):29-32. (吴健春, 路瑞芳, 马维平. 锌系与铝系盐处理钛白差异分析[J]. 钢铁钒钛, 2020,41(2):29-32.WU J C, LU R F, MA W P. Analysis of difference between zinc salt and aluminum salt treated titanium dioxide[J]. Iron Steel Vanadium Titanium, 2020, 41(2): 29-32. [3] LU R F, SUN Q, YANG F, et al. Study on effect of Al-Zn composite salt treatment on the quality of rutile TiO2[J]. Iron Steel Vanadium Titanium, 2022,43(3):14-19. (路瑞芳, 孙蔷, 杨芳, 等. 铝锌复合盐处理对金红石型TiO2质量的影响研究[J]. 钢铁钒钛, 2022,43(3):14-19.LU R F, SUN Q, YANG F, et al. Study on effect of Al-Zn composite salt treatment on the quality of rutile TiO2[J]. Iron Steel Vanadium Titanium, 2022, 43(3): 14-19. [4] CAO L, GAN W J, KE L H, et al. Effect of Al-doping solid phase method on growth of titanium dioxide crystal[J]. Coating and protection, 2021,42(4):44-47,62. (曹磊, 淦文军, 柯良辉, 等. Al掺杂对固相法制备TiO2晶体生长影响的研究[J]. 涂料技术与文摘, 2021,42(4):44-47,62.CAO L, GAN W J, KE L H, et al. Effect of Al-doping solid phase method on growth of titanium dioxide crystal[J]. Coating and protection, 2021, 42(4): 44-47,62. [5] RONG E Y, ZHU J W, CHEN K, et al. Effects of calcining seed, phosphate, and magnesium on titanium dioxide crystal[J]. Inorganic Chemicals Industry, 2016,48(7):21-24. (容尔益, 朱家文, 陈葵, 等. 煅烧晶种和磷、镁对二氧化钛晶体的影响[J]. 无机盐工业, 2016,48(7):21-24.RONG E Y, ZHU J W, CHEN K, et al. Effects of calcining seed, phosphate, and magnesium on titanium dioxide crystal[J]. Inorganic Chemicals Industry, 2016, 48(7): 21-24. [6] MA W P, SUN K, WANG H B. Effect of potassium hydroxide on preparation of rutile TiO2[J]. Iron Steel Vanadium Titanium, 2023,44(1):26-31. (马维平, 孙科, 王海波. 氢氧化钾对制备金红石型TiO2作用研究[J]. 钢铁钒钛, 2023,44(1):26-31.MA W P, SUN K, WANG H B. Effect of potassium hydroxide on preparation of rutile TiO2[J]. Iron Steel Vanadium Titanium, 2023, 44(1): 26-31. [7] SHIBUYA T, YASUOKA K, MIRBT S, et al. Bipolaron formation induced by oxygen vacancy at rutile TiO2(110) surfaces[J]. Jphyschemc, 2012,118(18):9429-9435. [8] LU R F, YANG F, LIU C, et al. Study on the effect and mechanism of Al3+ during the calcination of metatitanic acid[J]. Iron Steel Vanadium Titanium, 2023,44(4):25-32. (路瑞芳, 杨芳, 刘婵, 等. Al3+对偏钛酸煅烧过程的影响和作用机制研究[J]. 钢铁钒钛, 2023,44(4):25-32.LU R F, YANG F, LIU C, et al. Study on the effect and mechanism of Al3+ during the calcination of metatitanic acid[J]. Iron Steel Vanadium Titanium, 2023, 44(4): 25-32. [9] HAO Y Q, WANG Y F, WENG Y X. Particle-size-dependent hydrophilicity of TiO2 nanoparticles characterized by marcus reorganization energy of interfacial charge recombination[J]. The Journal of Physical Chemistry C, 2008,112(24):8995-9000. doi: 10.1021/jp802532w [10] TANG B W, NIU S, SUN C, et al. The superhydrophilicity and photocatalytic property of Zn-doped TiO2 thin films[J]. Ferroelectrics, 2019,549(1):96-103. doi: 10.1080/00150193.2019.1592548 [11] Wu C Y, Tu K J, DENG J P, et al. Markedly enhanced surface hydroxyl groups of TiO2 nanoparticles with superior water-dispersibility for photocatalysis[J]. Materials, 2017,10(5):566. doi: 10.3390/ma10050566 [12] HAO L P, CHAI S G, ZENG Y D, et al. A new method for accurate determination of OH groups density on silica surface[J]. Guangzhou Chemical Industry, 2019,47(4):93-94,121. (郝良鹏, 柴颂刚, 曾耀德, 等. 一种精确测定二氧化硅表面羟基数量的新方法[J]. 广州化工, 2019,47(4):93-94,121.HAO L P, CHAI S G, ZENG Y D, et al. A new method for accurate determination of OH groups density on silica surface[J]. Guangzhou Chemical Industry, 2019, 47(4): 93-94,121. [13] MUELLER R, KAMMLER H K, WEGNER K, et al. OH surface density of SiO2 and TiO2 by thermogravimetric analysis[J]. Langmuir, 2003,19(1):160-165. doi: 10.1021/la025785w [14] CHEN Y, ZHOU Y, LI Y J, et al. Zeta Potential measurement of high concentration nano-silica slurry[J]. PTCA (PART A : PHYS. TEST), 2020, 56(11): 19-24, 34. (陈鹰, 周莹, 厉艳君, 等. 高浓度纳米二氧化硅浆料Zeta电位的测量[J]. 理化检验(物理分册), 2020, 56(11): 19-24, 34.CHEN Y, ZHOU Y, LI Y J, et al. Zeta Potential measurement of high concentration nano-silica slurry[J]. PTCA (PART A : PHYS. TEST), 2020, 56(11): 19-24, 34. [15] GESENHUES U, RENTSCHLER T. Crystal growth and defect structure of Al3+-doped rutile[J]. International Journal of Quantum Chemistry, 1999,143(2):210-218. [16] LIU G, ZHANG X, XU Y, et al. The preparation of Zn2+-doped TiO2 nanoparticles by sol-gel and solid phase reaction methods respectively and their photocatalytic activities[J]. Chemosphere, 2005,59(9):1367-1371. doi: 10.1016/j.chemosphere.2004.11.072 [17] DING Y, ZHANG X, CHEN L, et al. Oxygen vacancies enabled enhancement of catalytic property of Al reduced anatase TiO2 in the decomposition of high concentration ozone[J]. Journal of Solid State Chemistry France, 2017(250):121-127. [18] KIEJNA A. Vacancy formation and O adsorption at the Al(111) surface - art. no. 235405[J]. Physical review, B Condensed matter and materials physics, 2003,68(23):235405. [19] WANG S G, WEN X D, CAO D B, et al. Formation of oxygen vacancies on the TiO2(110) surfaces[J]. Surface Science, 2005,577(1):69-76. doi: 10.1016/j.susc.2004.12.017 [20] MINATO T, KAWAI M, KIM Y. Creation of single oxygen vacancy on titanium dioxide surface[J]. Journal of Materials Research, 2012,27(17):2237-2240. doi: 10.1557/jmr.2012.157 [21] MATSUNAGA K, TANAKA Y, TOYOURA K, et al. Existence of basal oxygen vacancies on the rutile TiO2(110) surface[J]. Physical Review B, 2014,90(19):195303. doi: 10.1103/PhysRevB.90.195303 [22] VALENTIN C D, PACCHIONI G, SELLONI A. Electronic structure of defect states in hydroxylated and reduced rutile TiO2(110) surfaces[J]. Physical Review Letters, 2006,97(16):166803. doi: 10.1103/PhysRevLett.97.166803 [23] ZHAO L, MAGYARI-KÖPE B, NISHI Y. Polaronic interactions between oxygen vacancies in rutile TiO2[J]. Physical Review B, 2017,95(5):54104. doi: 10.1103/PhysRevB.95.054104 -





 下载:
下载:


 下载:
下载: